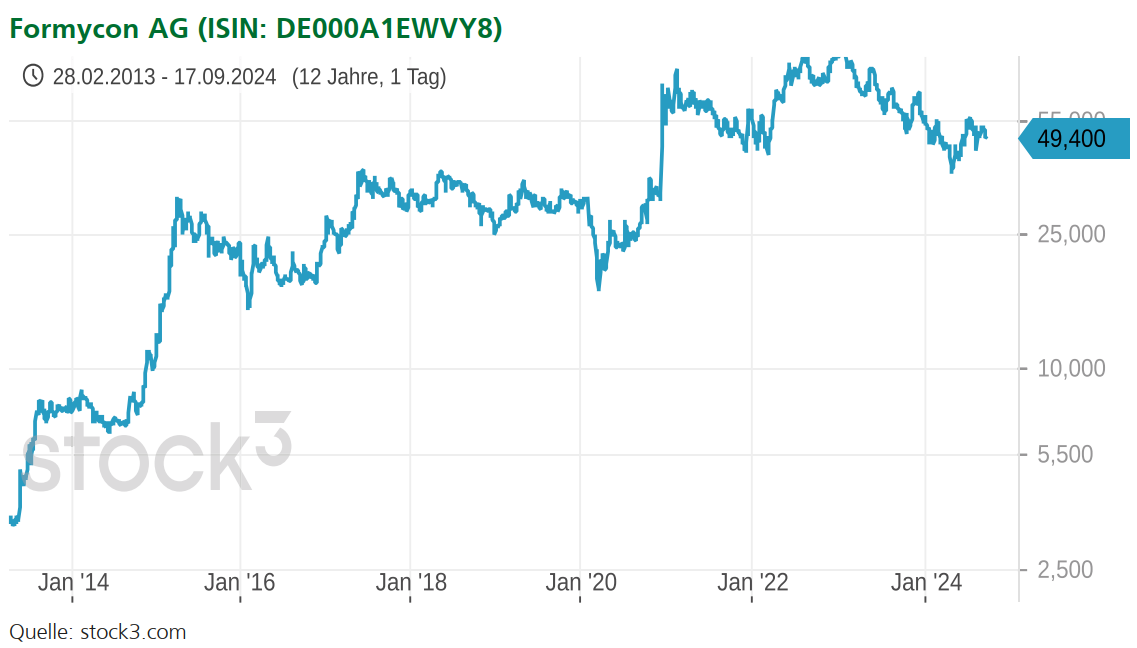
Bildnachweis: Geekminds – stock.adobe.com, Formycon AG, stock3.com.
Der Biosimilar-Spezialist Formycon steht nach der erfolgreichen Markteinführung des ersten zugelassenen Produkts mit den nächsten Zulassungen vor einer Schlüsseletappe in der zwölfjährigen Firmenhistorie. Finanzvorstand Enno Spillner erläutert, wie Formycon mit seinem Geschäftsmodell ein attraktives Risiko-Rendite-Profil für Anleger schafft.
Plattform Life Sciences: Biosimilars standen lange Zeit im Schatten anderer Medikamentenklassen. Hat sich dieses Bild gewandelt?
Spillner: Mit den zahlreichen Produktzulassungen und der erfolgreichen Etablierung der Biosimilars in den letzten Jahren sehen wir, dass in den USA und Europa das Investoreninteresse deutlich zunimmt, besonders seitdem in den Gesundheitssystemen der Effekt von Biosimilars als bezahlbare hochmoderne Arzneimitteloption spürbarer wird. Antikörper und proteinbasierte Therapien haben die Behandlung von etlichen Krankheiten revolutioniert – jedoch verbunden mit hohen Therapiekosten. Biosimilars bieten eine Alternative mit vergleichbarer Wirkung und Qualität zu deutlich niedrigeren Preisen.
Wie will sich Formycon in Zukunft im Biosimilar-Markt positionieren, in dem große Player wie Pfizer, Amgen und Sandoz eine dominierende Rolle in einzelnen Indikationen spielen?

Indem wir uns ausschließlich auf Biosimilars konzentrieren. Im Vergleich zu den Genannten, in deren Geschäftsmodell Biosimilars lediglich einen von mehreren Pfeilern bilden, sind wir mit unserem Know-how und unserer Expertise ausschließlich auf Biosimilars fokussiert. Eine solche Spezialisierung bringt klare Wettbewerbsvorteile, vor allem hinsichtlich der Agilität und Flexibilität im Entwicklungsprozess. Unsere Organisation umfasst ca. 250 Mitarbeitende – davon sind mehr als 80% Entwickler –, die bald sieben Biosimilar-Projekte parallel und in allen Entwicklungsstufen betreuen. Solch eine Leistung ist nur möglich durch klare Fokussierung und operative Exzellenz. Damit machen wir uns für Big Pharma zum Partner erster Wahl bei der Entwicklung von Biosimilars, denn diese Entwicklungsperspektive fehlt vielen der großen Player.
Ein Hindernis für den kommerziellen Erfolg von Biosimilars ist auf dem US-Markt das Bemühen der Originatoren, den Patentablauf über das Ausweiten der Patentfamilie zu strecken.
Nach dem Loss of Exclusivity, also dem Verlust der gesetzlichen Schutzfristen für ein Präparat, ist das eine mögliche Reaktion der Originatoren, die das Medikament entwickelt haben. Bei Eylea war das beispielsweise der Fall: über eine höhere Dosierung die kommerzielle Attraktivität zu erhalten. Letztendlich lässt sich damit aber nicht verhindern, dass Biosimilars das Feld betreten und für Wettbewerb sorgen. Grundsätzlich streben wir mit den Herstellern der Referenzarzneimittel eine Einigung über den Zeitpunkt des Markteintritts an. Das erfolgreiche Settlement mit Johnson & Johnson für FYB202 ist hierfür ein gutes Beispiel.
Worauf kommt es an, um den Referenzarzneimitteln, die Fachärzte über einen längeren Zeitraum verschrieben haben, bei den Ärzten und Patienten den Rang abzulaufen?
In erster Linie entscheidend ist, dass Ärzte und Patienten auf die Qualität, Sicherheit und Wirksamkeit von Biosimilars vertrauen können. Dies wird durch hochregulierte Entwicklungs- und Zulassungsprozesse sichergestellt, sodass ein Biosimilar vergleichbar mit dem Referenzarzneimittel ist. Auch wenn die Vertrauensbildung in diese relativ neue Medikamentenklasse etwas dauerte, kommen Biosimilars an und bieten mittlerweile eine äußerst zuverlässige Alternative in der Patientenversorgung.
Dennoch reden wir weiter von sechs bis acht Jahren Entwicklungszeit bei 150 Mio. bis 300 Mio. USD Kosten für ein Biosimilar. Anders als Generikafirmen müssen Biosimilar-Entwickler also reichlich Geld in die Hand nehmen.
Im Gegensatz zu den Generika, also chemisch synthetischen Arzneimitteln, befinden wir uns bei den Biosimilars, die den Biologika zuzuordnen sind, auf einem wesentlich komplexeren Entwicklungspfad, da diese in lebenden Zellen hergestellt werden. Insbesondere die klinischen Studien treiben Entwicklungsdauer und -kosten. Dadurch ergeben sich höhere Eintrittsbarrieren, weshalb es weniger Biosimilar- als Generikaentwickler gibt. Wir würden in Zukunft deutlich davon profitieren, sollten die bestehenden Diskussionen um einen Wegfall der klinischen Phase III für Biosimilars seitens der Regulatoren umgesetzt werden.
Formycon betreibt die Vermarktung über Partner. Worauf kommt es hierbei an?
Ganz klar auf die Expertise in den verschiedenen Märkten und deren Funktionsmechanismen. Coherus, unser ursprünglicher US-Partner für FYB201, hatte das Produkt hervorragend in den USA positioniert und zwischenzeitlich einen Marktanteil von über 40% erreicht. Wir sind davon überzeugt, dass unser neuer Partner Sandoz diese Arbeit mit einem etablierten Vertriebssystem erfolgreich fortsetzen wird. Dasselbe erhoffen wir uns für das Stelara-Biosimilar FYB202, das kurz vor der Zulassung steht. Unser Partner Fresenius Kabi verfügt in diesem Indikationsbereich bereits über Markterfahrung. Die bestehenden Marketing- und Vertriebskanäle können also synergetisch genutzt werden.
Die Umsatzbeteiligungen für FYB201 bewegen sich im einstelligen Prozentbereich. Wie will Formycon für die drei jüngeren Pipelinekandidaten höhere Royalty Payments als z.B. bei FYB201 herausschlagen?
FYB201 war vor allem der Proof of Concept für unsere Expertise. Durch die damalige frühe Auslizenzierung des Produkts ist die Royaltybeteiligung bei FYB201 – und auch bei FYB203 – noch etwas niedriger. FYB202, das wir vollständig kontrollieren, sieht kommerziell schon erheblich attraktiver aus. Bei den Kandidaten ab FYB206, die ebenfalls zu 100% unter unserer Kontrolle sind und in die wir selbst signifikant investieren, wird die Beteiligung am Vermarktungserfolg auch signifikant höher sein.
Sie erwähnen den Produktkandidaten FYB206, ein Biosimilar zum Immun-Checkpoint-Inhibitor KEYTRUDA, eine der umsatzstärksten und wichtigsten Krebsarzneien, die in den letzten 15 Jahren zugelassen wurden. Wie könnte sich ein KEYTRUDA-Biosimilar in diesen Markt einklinken?
Der Jahresumsatz mit KEYTRUDA wird Prognosen zufolge 2026 die 30-Mrd.-USD-Grenze überschreiten und ist bereits jetzt das umsatzstärkste Medikament weltweit. Damit ist das auch ein äußerst interessanter und lukrativer Markt für ein entsprechendes Biosimilar. Wir haben mit der klinischen Phase I und Phase III begonnen und befinden uns damit in der Führungsgruppe der Entwickler eines Biosimilars für den Antikörper Pembrolizumab.
In erster Linie entscheidend ist, dass Ärzte und Patienten auf die Qualität, Sicherheit und Wirksamkeit von Biosimilars vertrauen können.
Gedeon Richter hat sich 2024 zu 9,1% an Formycon beteiligt. Was versprechen Sie sich davon?
Gedeon Richter hat uns nicht nur 82,8 Mio. EUR an Cash über die Beteiligung eingebracht, sondern bereichert zudem unser Geschäft durch seine langjährige Expertise mit Biosimilars. Das Unternehmen ist ein strategischer Partner, mit dem wir bei verschiedenen Produktions- und Entwicklungsthemen kooperieren können. Wir haben jedoch weiterhin die Option, auch andere Partner für unsre Produkte zu gewinnen.
Vor allem für Small- und Mid Caps aus dem Biotech- und Medtechsektor waren die letzten zwei Jahre keine einfache Zeit an den Kapitalmärkten. Wie werden nach Ihren Erfahrungen Biosimilar-Spezialisten bei Investoren wahrgenommen?
Wir befinden uns im Spurwechsel von einem Biosimilar-Entwickler hin zu einem Unternehmen mit kommerziell erfolgreichen Produkten und einer attraktiven, wachsenden Pipeline. Immer mehr Investoren sehen das Marktpotenzial und welche Rolle Formycon dabei spielen kann. Vor allem unsere klare Fokussierung und die bisher gezeigte Zuverlässigkeit in der „Execution“ wird vonseiten der Investoren zunehmend honoriert und schafft Vertrauen.
Was sehen Sie als die wichtigsten Ziele auf Sicht der nächsten 24 Monate?
Die nächsten wichtigen Meilensteine sind ein kontinuierlicher Umsatzanstieg mit unseren nächsten Produkten. Mit FYB202 wollen wir bis Ende 2025 die ersten spürbaren Umsätze generieren. Die Grundlage dafür sind die Zulassungen in Europa und den USA, die wir ebenso wie die Kommerzialisierungspartnerschaft für FYB203 noch in diesem Jahr kommunizieren wollen. Anleger können sich also noch in diesem Jahr auf einen erheblichen Newsflow freuen.
Herzlichen Dank für das Gespräch.
Das Interview führte Stefan Riedel.
ZUM INTERVIEWPARTNER
Der studierte Diplom-Kaufmann Enno Spillner ist seit April 2023 Finanzvorstand der Formycon AG. Zuvor war er von 2005 bis 2016 Finanzvorstand der Martinsrieder Biotechfirma 4SC AG und darüber hinaus von 2013 bis 2016 Vorstandsvorsitzender des Unternehmens, ehe er im Juli 2016 bei der Evotec AG in Hamburg den Posten des Finanzvorstands übernahm.
Autor/Autorin

Stefan Riedel
Stefan Riedel ist freier Autor bei GoingPublic Media und selbständiger Redakteur mit Schwerpunkt Finanzen und Wirtschaft.