Diese Nachricht basiert auf einer Pressemitteilung von www.inflarx.com.
InflaRx N.V. (WKN: A2H7A5, ISIN: NL0012661870, Nasdaq: IFRX), ein biopharmazeutisches Unternehmen, das sich auf die Entwicklung von Anti-Inflammationstherapien spezialisiert hat, gibt bekannt, dass die Europäische Kommission die Marktzulassung für GOHIBIC (vilobelimab) erteilt hat. Die Zulassung umfasst die Behandlung erwachsener Patienten mit SARS-CoV-2-induziertem akutem Atemnotsyndrom (ARDS), die bereits mit systemischen Kortikosteroiden behandelt werden und eine invasive mechanische Beatmung (IMV) (mit oder ohne ECMO-Unterstützung) erhalten.
GOHIBIC ist damit die erste und einzige von der Europäischen Kommission zugelassene Behandlung für COVID-19-bedingtes ARDS. Die Zulassung stützt sich auf die Ergebnisse der PANAMO-Studie, einer der größten randomisierten, doppelblinden, placebokontrollierten Studien an intensiv beatmeten COVID-19-Patienten. In der Studie zeigte vilobelimab eine relative Reduktion der 28-Tage-Sterblichkeit um 23,9 % im Vergleich zu Placebo. Neben den 27 EU-Mitgliedsstaaten ist die Zulassung auch in Island, Liechtenstein und Norwegen gültig.
Prof. Niels C. Riedemann, Chief Executive Officer und Gründer von InflaRx, kommentierte: „Die Zulassung von GOHIBIC durch die Europäische Kommission, die erste Zulassung dieser Art, spiegelt unser Engagement für Intensivpatienten mit SARS-CoV-2-induziertem ARDS wider, ein dringendes medizinisches Problem, für das wirksamere Therapiemöglichkeiten benötigt werden. Ich möchte dem gesamten InflaRx-Team für seinen Einsatz und seine Sorgfalt danken, die zu dieser erfolgreichen Marktzulassung geführt haben, und wir sind dankbar für die Unterstützung durch die Intensivmediziner, Patienten und ihre Familien, die an der PANAMO-Studie teilgenommen haben, die den Antrag auf Marktzulassung unterstützt hat.“
InflaRx prüft derzeit Vertriebspartnerschaften in Europa, um den Marktzugang zu sichern und gleichzeitig die finanzielle Stabilität des Unternehmens zu gewährleisten.
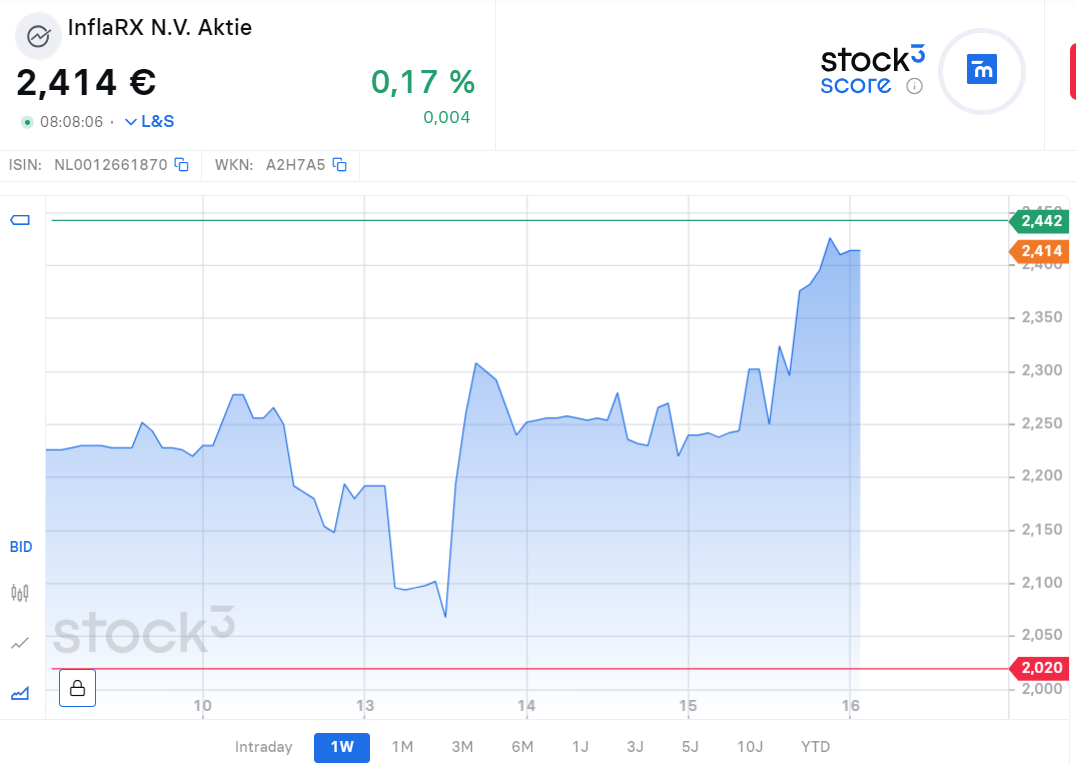
Die aktuelle Marktkapitalisierung von InflaRx beläuft sich derzeit auf EUR 143,56 Mio., bei einer ausgegebenen Stückzahl von 58,88 Mio. Aktien und einem Nennwert pro Aktie von EUR 2,438. Die Aktie von InflaRx reagierte unmittelbar auf die Nachricht über die Zulassung von GOHIBIC durch die Europäische Kommission. Der Kurs stieg von EUR 2,30 am 15. Januar (15:00 Uhr) auf EUR 2,438 am 16. Januar (8:00 Uhr), was einem Anstieg von etwa 6 % entspricht. Der moderate Kursanstieg verdeutlicht eine positive Marktreaktion auf die Nachricht. Die Zulassung von GOHIBIC markiert einen wichtigen Fortschritt für InflaRx, was die Erwartungen an künftige Marktchancen und Umsatzpotenziale des Unternehmens erhöht haben dürfte.
Über Vilobelimab
Vilobelimab ist ein monoklonaler Antikörper, der hochselektiv das Komplementfaktor C5a blockiert. Dies unterstützt das Immunsystem bei der Kontrolle entzündungsgetriebener Gewebeschäden, ohne die Bildung des Membranangriffskomplexes (C5b-9) zu beeinträchtigen, der eine wichtige Abwehrfunktion des angeborenen Immunsystems darstellt. Neben COVID-19-bedingtem ARDS wird Vilobelimab auch für andere schwere entzündliche Erkrankungen wie Pyoderma gangraenosum (PG) entwickelt.
Die Forschung zu COVID-19 wurde teilweise durch einen Zuschuss der deutschen Bundesregierung (16LW0113 – VILO-COVID) finanziert.
Autor/Autorin
Urs Moesenfechtel, M.A., ist seit 2021 Redaktionsleiter der GoingPublic Media AG - Plattform Life Sciences und für die Themenfelder Biotechnologie und Bioökonomie zuständig. Zuvor war er u.a. als Wissenschaftsredakteur für mehrere Forschungseinrichtungen tätig.