Bildnachweis: Ольга Лукьяненко – stock.adobe.com, https://www.advancecor.de/.
Diese Nachricht basiert auf einer Pressemitteilung der advanceCOR GmbH.
Die U.S. Food and Drug Association (FDA) hat in einem Typ-C-Meeting das präklinische und klinische Entwicklungsprogramm für Revacept / PR-15 der advanceCOR GmbH geprüft. advanceCOR ist ein im Jahr 2012 gegründetes Biotechnologie-Unternehmen mit Sitz in Martinsried bei München. Darüber hinaus wurde das zukünftige klinische Entwicklungsprogramm bis zur Marktzulassung vorgestellt und mit der FDA diskutiert.
Über Revacept
Revacept ist ein lösliches Biomolekül, das sich wie ein Pflaster über Schäden an Blutgefäßen legt. Es ist ein Fusionsprotein, das im Labor aus dem biotechnologisch hergestellten Glykoprotein GPVI und dem menschlichen Antikörper Immunglobulin G zusammengesetzt wird. Bei Gefäßschäden verhindert Revacept die Bildung gefährlicher Blutgerinnsel an Ort und Stelle, ohne die allgemeine Fähigkeit des Körpers, Blutungen zu stoppen, zu beeinträchtigen. Revacept hat sich laut Unternehmen n mehreren Studien als sicher, gut verträglich und wirksam erwiesen, darunter in einer 2021 veröffentlichten Studie mit Patienten mit koronarer Herzkrankheit.
Wirkweise von Revacept
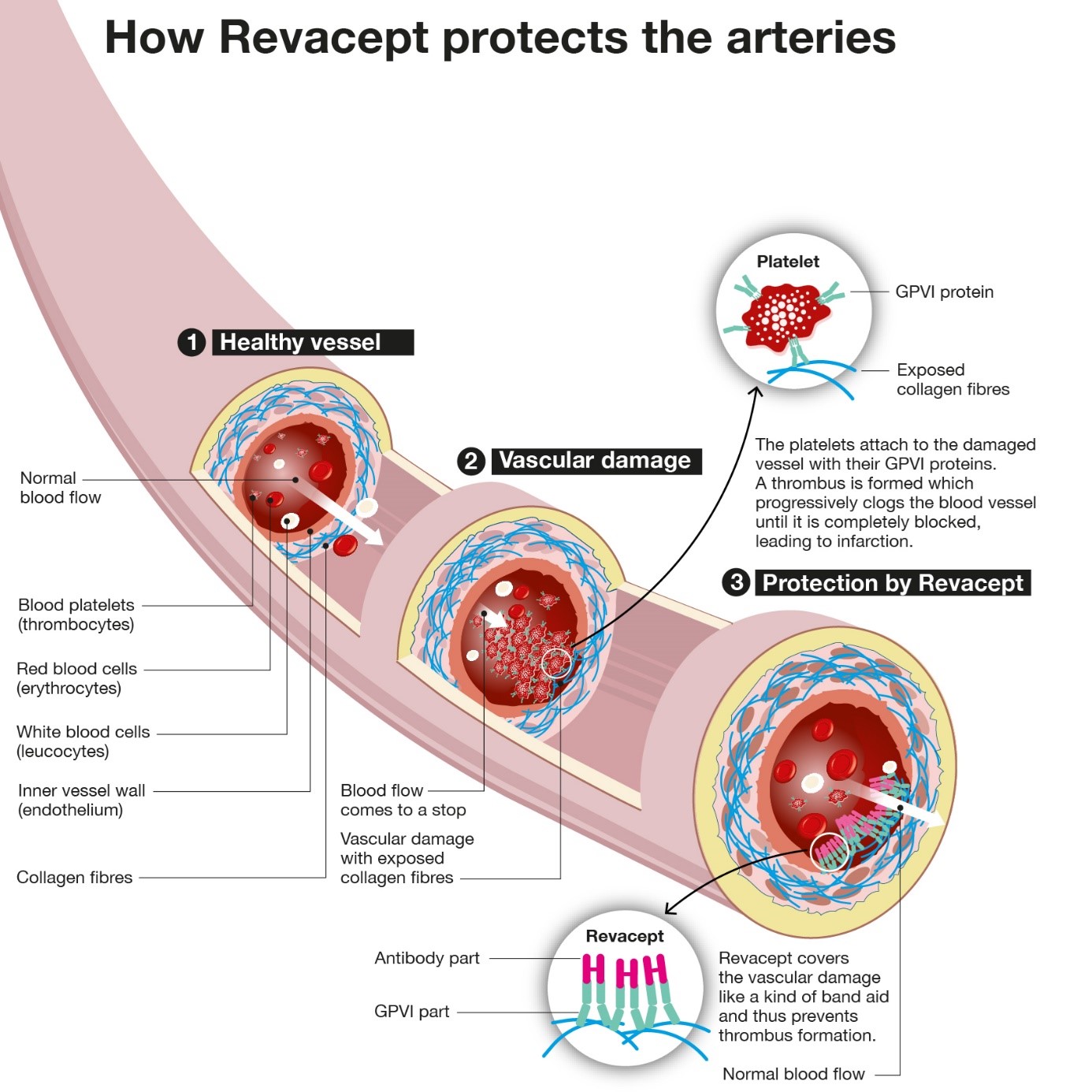
Gesunde Arterien (siehe Infografik, unten) sind mit einer glatten inneren Schicht, dem Endothel, ausgekleidet. Hier kann das Blut frei fließen – zusammen mit den roten und weißen Blutkörperchen und den viel kleineren Blutplättchen, die Schäden abdecken und Blutungen stoppen. Wenn das Endothel der Blutgefäße beschädigt ist (2), was beispielsweise bei Arteriosklerose der Fall ist, wird das darunter liegende Gewebe mit seinen Kollagenfasern freigelegt. Daran heften sich die herbeieilenden Blutplättchen mit Hilfe ihrer eigenen GPVI-Proteine an: Sie decken den Schaden ab und ziehen weitere Blutplättchen an. Dies führt oft zu einer überschießenden Reaktion mit Thrombusbildung, die das Blutgefäß vollständig verstopfen und zu einem Herzinfarkt oder Schlaganfall führen kann.
Dies kann mit dem Fusionsprotein Revacept verhindert werden. Es besteht aus zwei Komponenten: einem künstlich hergestellten Teil des plättchentypischen Proteins GPVI und einem Antikörperteil. Mit seinem GPVI-Teil kann es sich an die Gefäßschäden anlagern und als Lockvogel für freigelegte Kollagenfasern fungieren: Revacept bindet an diese Liganden anstelle der Blutplättchen, die an der beschädigten Stelle vorbeischwimmen, das Blut fließt ungehindert durch die Arterie (3).
Die vorgelegten klinischen und präklinischen Daten ergaben laut Unternehmen keine Sicherheitsbedenken und wurden von der FDA als ausreichend und vollständig angesehen, um direkt in eine klinische Studie der Phase 3 überzugehen.
AdvanceCOR präsentierte das Protokoll für eine zulassungsrelevante Phase-3-Studie bei Patienten mit symptomatischer Karotisstenose, die in den letzten 8 Tagen einen Schlaganfall erlitten haben. Zusätzliche Kommentare zu Details des Studienprotokolls wurden mit der FDA diskutiert. Die wichtigsten Merkmale des Phase-3-Studienprotokolls wurden vereinbart und von der FDA als pivotale Phase-3-Studie akzeptiert, um die Marktzulassung von Revacept zur Vorbeugung von wiederkehrenden Schlaganfällen zu ermöglichen.
Keine zusätzlichen Sicherheitsstudien nötig
Es sind laut Unternehmen keine zusätzlichen Sicherheits- oder Toxizitätsstudien notwendig, um das weitere klinische Entwicklungsprogramm in zulassungsrelevanten klinischen Studien zu ermöglichen. Das klinische Entwicklungsprogramm mit einer Phase-1-Studie und zwei Phase-2-Studien bei Patienten mit Karotisstenose und Schlaganfall sowie stabiler koronarer Herzkrankheit und Stentintervention ist laut Unternehmen somit die solide Basis für das weitere klinische Entwicklungsprogramm mit einer weiteren Zulassungsstudie, die die Marktzulassung ermöglicht.
Die Hauptgrundlage für die weitere Entwicklung von Revacept bei Schlaganfall war die vorangegangene Revacept CS/02-Studie an 160 Patienten mit symptomatischer Karotisstenose. Die doppelblinde, placebokontrollierte, randomisierte Studie verglich vor allem das Auftreten neuer ischämischer Ereignisse in seriellen MRT-Aufnahmen des Gehirns. Diese neuen Schlaganfälle traten unter der höheren Dosis von Revacept nur halb so häufig auf wie in der Placebogruppe. Bei einem kombinierten klinischen Endpunkt – Schlaganfall, Blutung oder Herzinfarkt – bewirkte Revacept im Vergleich zu Placebo eine signifikante Verringerung.
Die Sicherheit von Revacept wurde in einer Phase-2-Studie mit 330 Patienten mit stabilem Koronarsyndrom, die sich einer intravaskulären Intervention und Stentimplantation unterzogen, der ISAR-Plaster-Studie, weiter nachgewiesen.
Revacept setzt an dem entscheidenden Schritt der Plaque-vermittelten Thrombusbildung an. Dieser entscheidende Schritt ist auch bei der peripheren arteriellen Verschlusskrankheit (pAVK) von großer Bedeutung. Da Patienten mit peripherer arterieller Verschlusskrankheit (pAVK) trotz optimaler Revaskularisierung unter schweren Komplikationen mit Amputationsraten von 20 % pro Jahr leiden, sind verbesserte Behandlungen dringend erforderlich. Präklinische Daten sprechen laut Unternehmen für einen deutlichen Nutzen von Revacept bei der Neo-Intimabildung und Restenose nach endovaskulärer Intervention bei atherosklerotischen Tieren. In dieser vernachlässigten Indikation könnte Revacept eine neue Behandlungsoption darstellen, nachdem es neben Xarelto im Jahr 2021 lange Zeit keine Innovation für die Behandlung der pAVK gegeben hat.
Autor/Autorin
Urs Moesenfechtel, M.A., ist seit 2021 Redaktionsleiter der GoingPublic Media AG - Plattform Life Sciences und für die Themenfelder Biotechnologie und Bioökonomie zuständig. Zuvor war er u.a. als Wissenschaftsredakteur für mehrere Forschungseinrichtungen tätig.